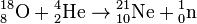(молярная масса)
(первый электрон)
тв. 1,444 г/см³ (при 24,66 К);
ж. 1,204 г/см³ (при −246 °C);
газ. 0,90035 кг/м³ (при 0 °C, 101,325 кПа) г/см³
Неон (Ne, лат. neon ) — химический элемент 18-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы) второго периода периодической системы с атомным номером 10.
Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Как простое вещество представляет собой инертный одноатомный газ без цвета и запаха. Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
Содержание
История
Неон открыли в июне 1898 года английские химики Уильям Рамзай и Морис Траверс. Они выделили этот инертный газ «методом исключения» после того, как кислород, азот, аргон и все более тяжёлые компоненты воздуха были сжижены. В декабре 1910 года французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространённость
Во Вселенной
В мировой материи неон распределён неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звёздах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна. В атмосфере многих звёзд неон занимает третье место после водорода и гелия.
Земная кора
Из всех стабильных элементов второго периода неон — самый малораспространённый на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82⋅10 −3 % по объёму, а его общие запасы оцениваются в 7,8⋅10 14 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объёме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7⋅10 −9 % по массе. Всего на нашей планете около 6,6⋅10 10 т неона. В изверженных породах находится около 10 9 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Определение
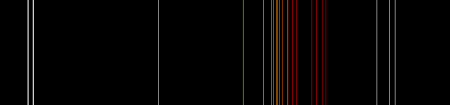
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
- Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
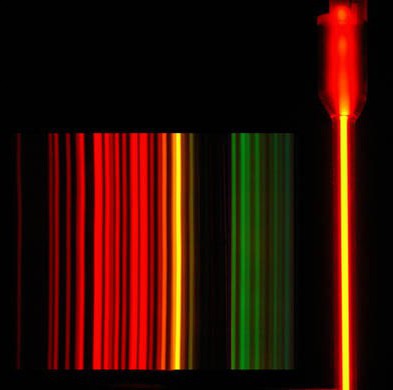
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности, неон — огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
- Насыщенность внешних электронных оболочек атомов инертных газов обусловливает более низкие точки сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства
Все благородные газы имеют завершённую электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6H2O), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne + , (NeAr) + , (NeH) + , и (HeNe) + .
Изотопы
Существует три стабильных изотопа неона: 20 Ne (изотопная распространённость 90,48 %), 21 Ne (0,27 %) и 22 Ne (9,25 %).
Кроме трёх стабильных нуклидов неона, существует ещё шестнадцать нестабильных изотопов. Повсеместно преобладает лёгкий 20 Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21 Ne и 22 Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21 Ne и 22 Ne — это захват альфа-частиц ядрами тяжёлого кислорода 18 O и фтора 19 F:
Источник преобладающего на Земле лёгкого нуклида 20 Ne до сих пор не установлен.
Обычно, Неон-20 образуется в звёздах вследствие альфа-процесса, при котором альфа-частица поглощается ядром атома кислорода
Но этот процесс требует температуры более 100 миллионов градусов и массы звезды более трех солнечных.
Вполне возможно, источником изотопа являлась сверхновая, после взрыва которой образовалось газопылевое облако, из части которого сформировалась Солнечная система.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20 Ne. В метеоритах обнаруживают немало 21 Ne и 22 Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха на крупных промышленных установках. Разделение «неоно-гелиевой» смеси осуществляется несколькими способами за счёт адсорбции и конденсации и низкотемпературной ректификации.
Адсорбционный метод основан на способности неона, в отличие от гелия, адсорбироваться активированным углём, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом, ректификационный способ основан на разнице температур кипения гелия и азота.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких H2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °C. В результате получают неон 99,9%-ной чистоты по объёму.
Основным промышленным способом получения неона (в последнее десятилетие) является разделение неоно-гелиевой смеси путём низкотемпературной ректификации — смесь неона и гелия предварительно очищают от примеси азота и водорода (водород выжигают в печи, заполненной катализатором), а азот в низкотемпературных дефлегматорах и в блоке криогенных адсорберов, заполненных активированным углём (уголь охлаждается змеевиками с кипящим в них под вакуумом азотом). После удаления азота неоно-гелиевая смесь сжимается компрессором и поступает в ректификационную колонну (предварительно охлаждаемая до температуры кипящего под вакуумом азота) для разделения. Для понижения температуры охлаждённая смесь дросселируется с 25 МПа до 0,2-0,3 МПа (в зависимости от режима работы установки). В верхней части колонны, из-под крышки конденсатора, отбирается гелий с примесью до 20 % неона, в нижней части колонны в жидком виде получается неон. В качестве холодильного цикла используется дроссельный холодильный цикл с рабочей средой-хладагентом чистым неоном. Ректификационный метод разделения неоно-гелиевой смеси позволяет получить неон чистотой до 99,9999 %.
Промышленные установки по получению неона высокой чистоты построены и успешно эксплуатируются на Украине — г. Мариуполь (предприятие «Ингаз») и г. Одесса (предприятие «Айсблик»), в Российской Федерации — г. Москва.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном. Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители. Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе. По традиции «неоновыми» часто называют также разрядные трубки других цветов, в реальности использующие свечение других благородных газов или флуоресцирующего покрытия (см. справа). Для получения любых цветов, кроме красного, используют электрический разряд в аргоне с добавлением небольших количеств паров ртути в газоразрядных трубках, изнутри покрытых люминофором нужного цвета свечения, преобразующих ультрафиолетовое излучение разряда в видимый свет, или разряд в смеси других благородных газов.
Неоновые лампы применяются для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, а при повышении давления первыми возникают симптомы «неврологического синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Высокая концентрация неона во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Источник статьи: http://chem.ru/neon.html
Неон как пишется в химии
Неон — элемент главной подгруппы восьмой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 10. Обозначается символом Ne (Neon). Пятый по распространённости элемент во Вселенной (после водорода, гелия, кислорода и углерода). Простое вещество неон (CAS-номер: 7440-01-9) — инертный одноатомный газ без цвета, вкуса и запаха.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространение
Земная кора
Из всех элементов второго периода неон — самый малочисленный на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10 −3 % по объему, а его общие запасы оцениваются в 7,8·10 14 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объеме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7·10 −9 % по массе. Всего на нашей планете около 6,6·10 10 т неона. В изверженных породах находится около 10 9 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете .
Определение
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
- Благородные газы — бесцветные одноатомные газы без цвета и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
- Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne + , (NeAr) + , (NeH) + , и (HeNe) + .
Изотопы неона
Существует три стабильных изотопа неона: 20 Ne (изотопная распространённость 90,48 %), 21 Ne (0,27 %) и 22 Ne (9,25 %) [10] . Повсеместно преобладает легкий 20 Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21 Ne и 22 Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21 Ne и 22 Ne — это захват альфа-частиц ядрами тяжелого кислорода 18 О и фтора 19 F:
Источник преобладающего на Земле лёгкого нуклида 20 Ne до сих пор не установлен.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20 Ne. В метеоритах обнаруживают немало 21 Ne и 22 Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует еще шестнадцать нестабильных.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха. Разделение гелия и неона осуществляется за счет адсорбции и конденсации. Адсорбционный метод основан на способности неона в отличие от гелия адсорбироваться активированным углем, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °С. В результате получают неон 99,9%-ной чистоты по объему.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень мало рассеивается туманом и мглой.
Биологическая роль
Неон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Интересные факты
«Неоновые огни» оправдывают своё название только в случае свечения красного цвета. Для получения других цветов используют ртуть и фосфор в определённых пропорциях или другие благородные газы.
Неон, Neon, Nе (10)
Химический элемент неон был открыт Рамзаем и Траверсом в 1898 г., через несколько дней после открытия криптона. Ученые отобрали первые пузырьки газа, образующегося при испарении жидкого аргона, и установили, что спектр этого газа указывает на присутствие нового элемента. Рамзай так рассказывает о выборе названия для этого элемента: «Когда мы впервый раз рассматривали его спектр, при этом находился мой 12-летний сын.»
Отец, — сказал он — как называется этот красивый газ?
Это еще не решено — ответил я.
Он новый? — полюбопытствовал сын.
Новооткрытый — возразил я.
Почему бы в таком случае не назвать его Novum, отец?
Это не подходит, потому что novum не греческое слово — ответил я.
Мы назовем его неоном, что по гречески значит новый, таким то образом газ получил свое название.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 | 3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 | 11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 | 19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 | 37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 | 55 Cs Цезий |
56 Ba Барий |
* | 72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 | 87 Fr Франций |
88 Ra Радий |
** | (104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * | 57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** | 89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Источник статьи: http://himsnab-spb.ru/article/ps/ne/
№10 Неон
История открытия:
В 1897 г. У. Рамзай, пользуясь “методом нашего учителя Менделеева”, предсказал существование простого газа с промежуточными между Не и Ar константами. Год спустя, У. Рамзай и М. Траверс, исследуя спектры фракций медленно испаряющегося жидкого воздуха, в спектре самой легкой и низкокипящей фракции, наряду с известными линиями азота, гелия и аргона, обнаружили красные и оранжевые линии, принадлежавшие новому элементу.
Название происходит от греческого “neos” — новый. Существует легенда, согласно которой название новому элементу дал двенадцатилетний сын Рамзая: увидев необычное ярко-красное излучение, испускаемое веществом в трубке для проведения спектрального анализа, он воскликнул: «Новый!».
Нахождение в природе и получение:
Неон – пятый по распространённости элемент во Вселенной, в атмосфере Солнца и многих других звезд неон занимает третье место после водорода и гелия. Природный неон состоит из трех стабильных нуклидов: 20 Ne (90,92% по объему), 21 Ne (0,257%) и 22 Ne (8,82%).
Содержание неона в атмосферном воздухе составляет 1,82*10 -3 % по объему (общие запасы 7,8·10 14 м 3 ). В 1 м 3 воздуха содержится около 18,2 см 3 неона. В земной коре содержится 7·10 -9 % неона, в морской воде – 2·10 -8 %.
Неон получают как побочный продукт при крупномаштабном разделении жидкого воздуха на кислород и азот. Образующуюся при этом «неоно-гелиевую» смесь разделяют несколькими способами за счет адсорбции, конденсации и низкотемпературной ректификации. Адсорбционный метод основан на способности неона в отличие от гелия адсорбироваться активированным углем, охлаждаемым жидким азотом.
Физические свойства:
Бесцветный газ. Температура кипения неона (при нормальном давлении) -245,9°C, температура плавления -248,6°C. Плотность при нормальных условиях 1,444 кг/м3. В 100 мл воды при 20°C растворяется около 10 мл неона. Аллотропии не имеет. При пропускании тока в газоразрядной трубке, заполненной неоном, неон ярко светится огненно-красным светом, так как самые яркие линии его спектра лежат в красной части.
Химические свойства:
Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne + , (NeAr) + , (NeH) + , и (HeNe) + . Известны содержащие неон так называемые эксимерные молекулы Ne2 и NeF. На переходах этих молекул из метастабильного состояния в несвязанное генерируется лазерное излучение.
Важнейшие соединения:
Клатрат неона, Ne·6Н2O – соединение включения
Применение:
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном. Смесь неона и гелия используют в качестве рабочей среды в газовых лазерах.
Неон применяют для наполнения газоразрядных трубок, индикаторных ламп. Трубки, заполненные смесью неона и азота (так называемые неоновые трубки, содержащие около 10 объемных % неона), при пропускании через них электрического разряда испускают красное свечение и широко используются в рекламе. Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой. “Неоновыми” часто называют трубки испускающие другой цвет, где а реальности используется свечение люминофоров или других инертных газов.
Неон в составе неоно-гелиевой-кислородной смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество неона перед гелием в том, что смесь меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия. Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Митриковская Л.
ТюмГУ, 501 группа, 2013 г.
Источник статьи: http://www.kontren.narod.ru/x_el/info10.htm
Неон – Neon
Химический элемент с атомным номером 10
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Неон | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешний вид | бесцветный газ, проявляющий оранжево-красное свечение при помещении в электрическое поле | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Ne) | 20,1797 ( 6) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Неон в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 18 (благородный газ es) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | p-блок | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Благородный газ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Конфигурация электронов | [He ] 2s 2p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | газ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 24,56 K (- 248,59 ° C, -415,46 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 27,104 K (-246,046 ° C, -410,883 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при стандартном давлении) | 0,9002 г / л | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при bp ) | 1,207 г / см | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| тройная точка | 24,556 K, 43,37 кПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критическая точка | 44,4918 K, 2,7686 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 0,335 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 1,71 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 20,79 Дж / (моль · К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 58 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 154 мкм | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Спектральные линии неона Спектральные линии неона |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | изначальный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристалл структура | гранецентрированная кубическая (fcc)  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука | 435 м / с (газ, при 0 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 49,1 × 10 Вт / (м · К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | диамагнитное | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | −6,74 · 10 см / моль (298 К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 654 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-01-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прогноз | Уильям Рамзи (1897) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первая изоляция | Уильям Рамзи Моррис Траверс (1898) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы неона | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Категория: Неон.
| ссылки |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Неон – это химический элемент с символом Neи атомный номер 10. Это благородный газ. Неон – это бесцветный, без запаха, инертный одноатомный газ в стандартных условиях, плотность которого составляет примерно две трети плотности воздуха. Он был открыт (вместе с криптоном и ксеноном ) в 1898 году как один из трех остаточных редких инертных элементов, остающихся в сухом воздухе после азота, кислород, аргон и диоксид углерода удаляли. Неон был вторым из этих трех инертных газов, который был открыт, и сразу же был признан новым элементом благодаря его ярко-красному спектру излучения. Название неон происходит от греческого слова νέον, среднего единственного числа от νέος (neos), что означает новый. Неон химически инертен, и незаряженные соединения неона неизвестны. соединения неона, известные в настоящее время, включают ионные молекулы, молекулы, удерживаемые вместе силами Ван-дер-Ваальса и клатратами.
во время космического нуклеогенеза элементов, большое количество неона образуется в процессе синтеза альфа-захвата в звездах. Хотя неон – очень распространенный элемент во Вселенной и Солнечной системе (он пятый по количеству в космосе после водорода, гелия, кислорода и углерода ), на Земле он встречается редко. Он составляет около 18,2 частей на миллион воздуха по объему (это примерно столько же, сколько молекулярная или мольная доля) и меньшую долю в земной коре. Причина относительной редкости неона на Земле и внутренних (земных) планетах заключается в том, что неон очень летуч и не образует соединений, которые могли бы закрепить его на твердых телах. В результате он ускользнул из планетезималей под теплом только что зажженного Солнца в ранней Солнечной системе. Даже внешняя атмосфера Юпитера несколько обеднена неоном, хотя и по другой причине.
Неон дает отчетливое красновато-оранжевое свечение при использовании в низком напряжении неоновые лампы накаливания, высоковольтные газоразрядные трубки и неоновые рекламные вывески. Красная линия излучения неона также вызывает хорошо известный красный свет гелий-неоновых лазеров. Неон используется в некоторых плазменных трубках и хладагентах, но имеет несколько других коммерческих применений. В промышленных масштабах он извлекается с помощью фракционной перегонки жидкого воздуха . Поскольку воздух является единственным источником, он значительно дороже гелия.
Содержание
- 1 История
- 2 Изотопы
- 3 Характеристики
- 4 Возникновение
- 5 Химия
- 6 Приложения
- 7 См. Также
- 8 Ссылки
- 9 Внешние ссылки
История
Неон был открыт в 1898 году британскими химиками сэром Уильямом Рамзи (1852–1916) и Моррис В. Трэверс (1872–1961) в Лондоне. Неон был обнаружен, когда Рамзи охладил образец воздуха до тех пор, пока он не превратился в жидкость, затем нагрел жидкость и захватил газы по мере их выкипания. Газы азот, кислород и аргон были идентифицированы, но оставшиеся газы были изолированы примерно в порядке их содержания в течение шестинедельного периода, начинающегося с в конце мая 1898 года. Первым был идентифицирован криптон. Следующим, после того как был удален криптон, был газ, который давал ярко-красный свет при спектроскопическом разряде. Этот газ, обнаруженный в июне, был назван «неон», греческий аналог латинского novum («новый»), предложенный сыном Рамзи. Сразу же был отмечен характерный яркий красно-оранжевый цвет, излучаемый газообразным неоном при электрическом возбуждении. Позже Трэверс писал: «Вспышка малинового света из трубки рассказывала свою собственную историю и была зрелищем, на котором можно остановиться и никогда не забыть».
Сообщалось также о втором газе, наряду с неоном, примерно такой же плотности. как аргон, но с другим спектром – Рамзи и Трэверс назвали его метаргоном. Однако последующий спектроскопический анализ показал, что он загрязнен аргоном монооксидом углерода. Наконец, та же команда обнаружила ксенон тем же способом в сентябре 1898 года.
Дефицит Неона препятствовал его быстрому применению для освещения по линиям трубок Мура, которые использовали азот и начали коммерциализацию в начале 1900-х годов. После 1902 года компания Жоржа Клода Air Liquide производила промышленное количество неона в качестве побочного продукта своего бизнеса по сжижению воздуха. В декабре 1910 года Клод продемонстрировал современное неоновое освещение на основе запаянной неоновой трубки. Клод ненадолго попытался продать неоновые лампы для внутреннего домашнего освещения из-за их интенсивности, но рынок потерпел неудачу, потому что домовладельцы возражали против цвета. В 1912 году партнер Клода начал продавать неоновые газоразрядные трубки в качестве привлекательных рекламных вывесок и сразу же добился большего успеха. Неоновые трубки были представлены в США в 1923 году с двумя большими неоновыми вывесками, купленными автомобильным дилером Packard в Лос-Анджелесе. Свечение и привлекательный красный цвет сделали неоновую рекламу совершенно отличной от конкурентов. Интенсивный цвет и яркость неона приравнивались к американскому обществу того времени, предлагая «век прогресса» и превращая города в сенсационные новые среды, наполненные сияющей рекламой и «электро-графической архитектурой».
Неон сыграл роль роль в основных представлениях о природе атомов в 1913 году, когда Дж. Дж. Томсон, в рамках своего исследования состава лучей канала, направил потоки неоновых ионов через магнитное и электрическое поля и измерил отклонение потоков с помощью фотографической пластинки. Томсон наблюдал два отдельных пятна света на фотографической пластинке (см. Изображение), что предполагало две разные параболы отклонения. В конце концов Томсон пришел к выводу, что некоторые из атомов в неоновом газе имеют более высокую массу, чем остальные. Хотя в то время Томсон не понял этого, это было первое открытие изотопов из стабильных атомов. Устройство Томсона было грубой версией прибора, который мы сейчас называем масс-спектрометром.
Изотопами
Неон – второй по легкости инертный газ. Неон имеет три стабильных изотопа : Ne (90,48%), Ne (0,27%) и Ne (9,25%). Ne и Ne частично первичны и частично нуклеогенны (т.е. образуются в результате ядерных реакций других нуклидов с нейтронами или другими частицами в окружающей среде) и их вариации в естественном содержании Хорошо поняли. Напротив, Ne (главный первичный изотоп, образованный в звездном нуклеосинтезе ), как известно, не является нуклеогенным или радиогенным. Таким образом, горячо обсуждаются причины изменения Ne на Земле.
Основные ядерные реакции, генерирующие нуклеогенные неоновые изотопы, начинаются с Mg и Mg, которые производят Ne и Ne соответственно, после захвата нейтронов и немедленного выброса альфа-частицы. нейтроны, которые вызывают реакции, в основном образуются в результате вторичных реакций расщепления от альфа-частиц, которые, в свою очередь, происходят из цепочек распада урана серии . Конечный результат дает тенденцию к более низким отношениям Ne / Ne и более высоким отношениям Ne / Ne, наблюдаемым в богатых ураном породах, таких как граниты. Ne также может образовываться в нуклеогенной реакции, когда Ne поглощает нейтрон от различных естественные земные источники нейтронов.
Кроме того, изотопный анализ обнаженных земных горных пород продемонстрировал космогенное (космические лучи) образование Ne. Этот изотоп образуется в результате реакций расщепления на магнии, натрия, кремнии и алюминии. Анализируя все три изотопа, можно выделить космогенный компонент из магматического неона и нуклеогенного неона. Это говорит о том, что неон будет полезным инструментом для определения возраста космического воздействия поверхностных пород и метеоритов.
Подобно ксенону, содержание неона, наблюдаемое в образцах вулканических газы обогащены Ne и нуклеогенным Ne по отношению к содержанию Ne. Изотопное содержание неона в этих образцах, полученных из мантии, представляет собой внеатмосферный источник неона. Компоненты, обогащенные Ne, относятся к экзотическим первичным компонентам инертного газа на Земле, возможно, представляющим солнечный неон. Повышенное содержание Ne обнаружено в алмазах, что дополнительно указывает на наличие солнечно-неонового резервуара на Земле.
Характеристики
Неон является вторым по легкости благородным газом после гелий. Он светится красновато-оранжевым светом в вакуумной газоразрядной трубке . Кроме того, у неона самый узкий диапазон жидкостей из всех элементов: от 24,55 до 27,05 К (от -248,45 ° C до -245,95 ° C или от -415,21 ° F до -410,71 ° F). Его холодопроизводительность (на единицу объема) более чем в 40 раз выше, чем у жидкого гелия и в три раза больше, чем у жидкого водорода. В большинстве случаев это менее дорогой хладагент, чем гелий.

Неоновая плазма имеет наиболее интенсивный свет разряд при нормальных напряжениях и токах всех благородных газов. Средний цвет этого света для человеческого глаза красно-оранжевый из-за множества линий в этом диапазоне; он также содержит яркую зеленую линию, которая скрыта, если визуальные компоненты не рассредоточены с помощью спектроскопа.
Обычно используются два совершенно разных типа неонового освещения. Неоновые лампы накаливания, как правило, крошечные, большинство из которых работают от 100 до 250 вольт. Они широко используются в качестве индикаторов включения и в оборудовании для тестирования цепей, но светодиоды (светодиоды) сейчас преобладают в этих приложениях. Эти простые неоновые устройства были предшественниками плазменных дисплеев и экранов плазменных телевизоров. Неоновые вывески обычно работают при гораздо более высоких напряжениях (2–15 киловольт ), а световые трубки обычно имеют длину в несколько метров. Стеклянные трубки часто имеют формы и буквы для вывесок, а также для архитектурных и художественных приложений.

Происхождение
Стабильные изотопы неона образуются в звездах. Самый распространенный изотоп неона Ne (90,48%) создается в результате ядерного синтеза углерода и углерода в процессе сжигания углерода звездного нуклеосинтеза. Для этого требуются температуры выше 500 мегакельвинов, которые встречаются в ядрах звезд с массой более 8 солнечных масс.
Неон широко распространен в мировом масштабе; это пятый по численности химический элемент во Вселенной по массе после водорода, гелия, кислорода и углерода (см. химический элемент ). Его относительная редкость на Земле, как и гелий, объясняется его относительной легкостью, высоким давлением пара при очень низких температурах и химической инертностью – всеми свойствами, которые не позволяют ему попасть в конденсирующиеся газовые и пылевые облака, которые сформировали меньшие и более теплые твердые планеты, такие как Земля.

Неон одноатомный, что делает его легче, чем молекулы двухатомного азота и кислорода, которые составляют основную часть атмосферы Земли; воздушный шар, наполненный неоном, поднимется в воздух, хотя и медленнее, чем гелиевый шар.
Обилие неона во Вселенной составляет примерно 1 часть из 750; на Солнце и, предположительно, в туманности прото-Солнечной системы, примерно 1 часть из 600. Космический аппарат Galileo атмосферный входной зонд обнаружил, что даже в верхних слоях атмосферы Юпитера количество неона уменьшается (истощается) примерно в 10 раз, до уровня 1 части на 6000 по массе. Это может указывать на то, что даже ледяные планетезимали, которые принесли неон на Юпитер из внешней солнечной системы, сформировались в области, которая была слишком теплой, чтобы удерживать неоновую атмосферную составляющую (содержание более тяжелых инертных газов на Юпитере несколько раз больше, чем на Солнце).
Неон составляет 1 часть из 55000 в атмосфере Земли, или 18,2 частей на миллион по объему (это примерно столько же, сколько молекула или мольная доля), или 1 часть на 79 000 воздуха по массе. Он составляет меньшую долю корки. Промышленно он производится путем криогенной фракционной перегонки сжиженного воздуха.
17 августа 2015 года, на основе исследований с космическим кораблем Lunar Atmosphere and Dust Environment Explorer (LADEE), Ученые НАСА сообщили об обнаружении неона в экзосфере луны.
Химия
Неон является первым p -блок благородный газ и первый элемент с истинным октетом электронов. Он инертен : как и его более легкий аналог, гелий, прочно связанные нейтральные молекулы, содержащие неон, не идентифицированы. Ионы [Ne Ar ], [Ne H ] и [HeNe] наблюдались с помощью оптических и масс-спектрометрических исследований. Твердый гидрат клатрата неона был получен из водяного льда и неонового газа при давлениях 0,35–0,48 ГПа и температурах около -30 ° C. Атомы Ne не связаны с водой и могут свободно перемещаться через этот материал. Их можно извлечь, поместив клатрат в вакуумную камеру на несколько дней, получив лед XVI, наименее плотную кристаллическую форму воды.
Знакомая шкала электроотрицательности Полинга зависит от энергий химической связи, но такие значения, очевидно, не измерялись для инертного гелия и неона. Шкала электроотрицательности Аллена, которая полагается только на (измеримые) атомные энергии, определяет неон как наиболее электроотрицательный элемент, за которым следуют фтор и гелий.
Приложения
Неон часто используется в знаках и дает безошибочно яркий красновато-оранжевый свет. Хотя ламповые светильники других цветов часто называют «неоновыми», они используют различные благородные газы или различные цвета флуоресцентного освещения.
Неон используется в электронных лампах, высоковольтных индикаторах, молниеотводах, измерителях волн, телевизионных лампах, и гелий-неоновые лазеры. Сжиженный неон коммерчески используется в качестве криогенного хладагента в приложениях, не требующих более низкого диапазона температур, достигаемого при более экстремальном охлаждении жидким гелием.
Неон, как жидкость или газ, относительно дорог – при небольших количествах цена жидкого неона может быть более чем в 55 раз дороже жидкого гелия. Расходы на неон – это редкость неона, который, в отличие от гелия, можно получить только из воздуха.
Тройная точка температура неона (24,5561 K) является определяющей фиксированной точкой в Международной температурной шкале 1990 г..
Источник статьи: http://ru.wikibrief.org/wiki/Neon
Что такое неон? Особенности химического элемента и его свойства как простого вещества
Химический элемент неон широко распространен во Вселенной, а вот на Земле он считается довольно редким. Тем не менее, его научились получать и без визитов в открытый космос, и теперь его применяют в промышленности, для изготовления радио- и фототехники, а также для глубоководного дайвинга. Что такое неон? Какими свойствами и особенностями он обладает? Об этом мы и поговорим.
Что такое неон?
В Периодической таблице Менделеева этот элемент располагается в восьмой группе под номером десять. Он обозначается символом Ne. В качестве простого вещества он представляет собой одноатомный газ, который не имеет запаха, цвета и вкуса.
Он существует в виде трех изотопов 20 Ne, 21 Ne и 22 Ne, стабильных по своей природе. Чаще всего встречается именно нуклид 20 Ne. В атмосфере нашей планеты его распространенность составляет почти 90%, а то время как у изотопа 22 Ne – 9,25 %, а у изотопа 21 Ne – только 0,27 %. Последние два изотопа образуются в основном благодаря космическому излучению, которое воздействует на ядра натрия, кремния, алюминия и других элементов. Именно поэтому на Земле они чаще всего присутствуют в воздухе, а не в воде или земной коре. Источник образования на нашей планете Неона-20 до сих пор не известен. Кроме этих изотопов, известно выделяют около 16 нестабильных нуклидов с периодом распада от 9 зептосекунд до 3,38 минуты.
История открытия
О том, что такое неон, стало известно только в конце XIX века. До этого наука открыла лишь два инертных газа – аргон и гелий, занимающих первый и третий периоды таблицы Менделеева. При этом место второго периода оставалось пустым, поэтому исследователи предполагали о существовании в природе, как минимум еще одного подобного вещества. В 1997 году шотландский химик Рамзай даже посвятил ему доклад, который так и назывался «Неоткрытый газ». А уже в следующем году ему посчастливилось обнаружить недостающий элемент.
Чтобы найти его, ученый анализировал гелий и арагон, изучал состав минералов, но успех пришел, когда тот обратился к воздуху. Он сжижал и медленно испарял газовую смесь, а затем по фракциям пропускал ее через специальную разрядную трубку с электрическим током. Неоткрытое вещество должно было иметь свойства близкие к гелию, поэтому Рамзай надеялся обнаружить его в самой легкой фракции, которая испарится раньше всего.
Так и произошло. Взаимодействуя с электронами в трубке, первая фракция воздуха начала светиться, и рядом со спектром гелия и аргона ученый увидел и другие линии. Они стали подтверждением того, что существования ранее неизвестного газа. Открытому элементу Рамзай дал греческое название «неон», что в переводе означает «новый».
Свойства
О том, что такое неон, лучше всего судить исходя из его физических и химических свойств. Этот газ является одним из самых легких. Его плотность составляет 0,0089999 г/см³. Закипает он при температуре −246,05 °C, а плавится при −248,6 °C.
Неон практически не реагирует с другими веществами. Он с трудом отдает или присоединяет к себе электроны, поэтому его относят к благородным газам. По инертности с ним может сравниться только гелий. До сих пор не удалось получить ни одного его валентного соединения. Он слабо растворяется в воде, но неплохо адсорбируется активированным углем.
Как и другие благородные газы, он обладает хорошей электропроводностью. Если провести через него ток высокого напряжения – он начнет светиться. В спектре газа насчитывается около 900 линий разных цветов, но самые яркие из них – красные и оранжевые. Такое свойство неона нашло широкое применение в сфере наружной рекламы. Уже через двенадцать лет после его открытия на улицах стали появляться красные светящиеся вывески с названиями магазинов и кафе. Первый патент на них оформила компания Claude Neon Lights Inc.
Распространение в природе
Неон, или Ne, можно назвать внеземным газом, ведь в открытом космосе и на других астрономических объектах его гораздо больше, чем на нашей планете. Особенно много его в атмосфере Урана, Нептуна, Сатурна, Юпитера, в туманностях и очень горячих звездах. Кроме того, он содержится в метеоритах и других космических телах.
Во всей Вселенной газ занимает пятое место по распространенности, уступая пальму первенства водороду, гелию, кислороду и углероду. Его содержание по массе составляет примерно 0,13 % по массе.
На Земле он считается редким элементом. В земной коре его содержится около 7·10 −9 %, примерно 2·10 −8 % – в водах океана и соленых водоемах. Наибольшая концентрация этого химического элемента наблюдается в атмосфере планеты, там его содержание составляет 1,82·10 −3 % по объему.
Как его получают?
Из-за небольшой распространенности неона в горных породах и воде, его основным источником является атмосферный воздух. Из него газ получают при помощи сильного охлаждения. При температуре жидкого азота неон кристаллизуется и легко отделяется от гелия, который при этом остается в газообразном состоянии.
Его также получают в качестве побочного продукта, во время добычи из воздуха азота и кислорода. В таком случае, для отделения газа используют адсорбции активированным углем. Для определения неона обычно применяется спектральное излучение или хроматографический анализ.
Сферы использования
Химический элемент неон до сих пор применяется в вывесках и рекламных баннерах, при этом для получения разных цветов его смешивают и с другими веществами. Вместе с гелием он используется при изготовлении лазеров, самостоятельно – для производства фотоаппаратуры.
Жидкий неон обладает лучшей теплоемкостью, чем гелий, и стоит гораздо дешевле. Вместе с водородом его применяют в качестве хладагента для различных холодильных установок. Криогенные камеры на основе этих газов необходимы в медицине для замораживания живых тканей. Смесь неона и гелия используется для облегчения состояния пациентов с затруднением дыхания, для этого ее распространяют в комнатах которые наполняют безазотным воздухом.
Источник статьи: http://www.syl.ru/article/399776/chto-takoe-neon-osobennosti-himicheskogo-elementa-i-ego-svoystva-kak-prostogo-veschestva
Неон — самый инертный газ на Земле
Об элементе
Неон (химический символ — Ne; лат. Neon) — элемент восемнадцатой группы (по устаревшей классификации — главной подгруппы восьмой группы), второго периода периодической системы химических элементов, с атомным номером 10. Инертный газ. Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Простое вещество неон — инертный одноатомный газ без цвета и запаха. Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
Неон открыли в июне 1898 года английские химики Уильям Рамзай и Морис Траверс. Они выделили этот инертный газ «методом исключения» после того, как кислород, азот и все более тяжёлые компоненты воздуха были сжижены. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Физические свойства
Свечение неона в газоразрядной трубке.
Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
Эмиссионный спектр неона (слева направо: от ультрафиолетовых до инфракрасных линий. Линии, находящиеся в невидимых глазом участках спектра, изображены белым цветом).
Насыщенность внешних электронных оболочек атомов инертных газов обусловливает более низкие точки сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Символ элемента, выполненный из неоновых трубок
Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе. По традиции «неоновыми» часто называют также разрядные трубки других цветов, в реальности использующие свечение других благородных газов или флуоресцирующего покрытия (см. справа).
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Стихи про неон
Город многомиллионный.
Светятся огни Неона.
Ярко-красная реклама.
Интересно, знает мама,
Что же за волшебный газ
Так притягивает вас –
Лену, Диму, Катю, Петю?
Это газ инертный светит!
Может, Гелий? Нет, не он!
В этих лампочках Неон!
Газ ленивый, от Неона
Не дождёшься электрона.
У Неона крепкий атом,
И решительным ребятам –
Фтору, Хлору, Кислороду –
Этот атом не разбить!
Предпочтет Неон свободу,
Он инертным будет жить!
Над материей не властен,
И ленивый очень он.
В лампах он нашел значение,
В криогене новый дом!
Он без запаха и вкуса.
И на цвет такой же он.
Но сквозь вольтного разряда
Красным станет, будь здоров.
Он инертный, очень сонный.
Не вступает ни с кем в свет.
И с водой, черт подзаборный,
Выступает на «О, нет!»
Во вселенной его много.
Пятый в ряде, это да!
Водорода не собьет он.
Но есть ли смысл, господа?
Он в больнице применяем,
Вместе с гелием-собратом.
Он больным с плохим дыханием
Облегчает состояние.
Но в высокой концентрации,
Он опасен, так и знай.
Даже ряди иллюстрации,
Не вдыхай его ты в край.
Подобно солнечной системе
В пространстве атом твой парит,
Там маленьких планеток семьи
На перекрестиях орбит.
Уравновешивая строго
Их отрицательный заряд,
Там, в ядерных твоих чертогах,
Десяток карликов сидят.
А чтоб они сидели рядом,
Не разлетелись все подряд,
Их оградил своим отрядом
Десяток нейтро-негритят.
Твоих орбит объятья крепки,
Полна их дружная семья,
И ни одной отнять планетки
Другому атому нельзя!
Ни Фтор — заносчивый воитель,
Ни Натрий — щедрый и шальной,
Не ворвались в твою обитель,
Твой не нарушили покой!
А ты совсем не зазнавался,
В огнях ночных реклам светил,
И даже рыбке, постарался,
Своё названье подарил…
Перед таблицей элементов
Стою, чуть сдерживая стон,
А в голове — вопросов ленты:
Где ж он? Не он…
Не он… Не он…
Перед таблицей элементов
Стою, чуть сдерживая стон,
А в голове — вопросов ленты:
Где ж он?
Не-он…
Не-он…
Не-он…
Вы, ребята, мне поверьте —
Этот газ вполне инертен
Он спокойный и ленивый,
В трубках светится красиво.
Для рекламы нужен он,
Незаметный газ…
(Неон)
Может в трубке он светиться,
Отгадай его, дружок,
Отрицания частица –
В этом слове первый слог.
Местоимение – второй.
Инертный газ скорей открой!
(Неон)
Неон — самый инертный газ на Земле
Об элементе
Неон (химический символ — Ne; лат. Neon) — элемент восемнадцатой группы (по устаревшей классификации — главной подгруппы восьмой группы), второго периода периодической системы химических элементов, с атомным номером 10. Инертный газ. Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Простое вещество неон — инертный одноатомный газ без цвета и запаха. Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
Неон открыли в июне 1898 года английские химики Уильям Рамзай и Морис Траверс. Они выделили этот инертный газ «методом исключения» после того, как кислород, азот и все более тяжёлые компоненты воздуха были сжижены. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Физические свойства
Свечение неона в газоразрядной трубке.
Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
Эмиссионный спектр неона (слева направо: от ультрафиолетовых до инфракрасных линий. Линии, находящиеся в невидимых глазом участках спектра, изображены белым цветом).
Насыщенность внешних электронных оболочек атомов инертных газов обусловливает более низкие точки сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Символ элемента, выполненный из неоновых трубок
Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе. По традиции «неоновыми» часто называют также разрядные трубки других цветов, в реальности использующие свечение других благородных газов или флуоресцирующего покрытия (см. справа).
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Стихи про неон
Город многомиллионный.
Светятся огни Неона.
Ярко-красная реклама.
Интересно, знает мама,
Что же за волшебный газ
Так притягивает вас –
Лену, Диму, Катю, Петю?
Это газ инертный светит!
Может, Гелий? Нет, не он!
В этих лампочках Неон!
Газ ленивый, от Неона
Не дождёшься электрона.
У Неона крепкий атом,
И решительным ребятам –
Фтору, Хлору, Кислороду –
Этот атом не разбить!
Предпочтет Неон свободу,
Он инертным будет жить!
Над материей не властен,
И ленивый очень он.
В лампах он нашел значение,
В криогене новый дом!
Он без запаха и вкуса.
И на цвет такой же он.
Но сквозь вольтного разряда
Красным станет, будь здоров.
Он инертный, очень сонный.
Не вступает ни с кем в свет.
И с водой, черт подзаборный,
Выступает на «О, нет!»
Во вселенной его много.
Пятый в ряде, это да!
Водорода не собьет он.
Но есть ли смысл, господа?
Он в больнице применяем,
Вместе с гелием-собратом.
Он больным с плохим дыханием
Облегчает состояние.
Но в высокой концентрации,
Он опасен, так и знай.
Даже ряди иллюстрации,
Не вдыхай его ты в край.
Подобно солнечной системе
В пространстве атом твой парит,
Там маленьких планеток семьи
На перекрестиях орбит.
Уравновешивая строго
Их отрицательный заряд,
Там, в ядерных твоих чертогах,
Десяток карликов сидят.
А чтоб они сидели рядом,
Не разлетелись все подряд,
Их оградил своим отрядом
Десяток нейтро-негритят.
Твоих орбит объятья крепки,
Полна их дружная семья,
И ни одной отнять планетки
Другому атому нельзя!
Ни Фтор — заносчивый воитель,
Ни Натрий — щедрый и шальной,
Не ворвались в твою обитель,
Твой не нарушили покой!
А ты совсем не зазнавался,
В огнях ночных реклам светил,
И даже рыбке, постарался,
Своё названье подарил…
Перед таблицей элементов
Стою, чуть сдерживая стон,
А в голове — вопросов ленты:
Где ж он? Не он…
Не он… Не он…
Перед таблицей элементов
Стою, чуть сдерживая стон,
А в голове — вопросов ленты:
Где ж он?
Не-он…
Не-он…
Не-он…
Вы, ребята, мне поверьте —
Этот газ вполне инертен
Он спокойный и ленивый,
В трубках светится красиво.
Для рекламы нужен он,
Незаметный газ…
(Неон)
Может в трубке он светиться,
Отгадай его, дружок,
Отрицания частица –
В этом слове первый слог.
Местоимение – второй.
Инертный газ скорей открой!
(Неон)
Что такое неон? Химические и физические свойства неона, применение
Среди всех элементов химической таблицы Менделеева интересными свойствами обладает такая группа, как инертные газы. К ним относится аргон, неон, гелий и некоторые другие вещества. Что такое неон, и где в современном мире этот газ нашел широкое применение?
История открытия неона
Таблица Менделеева не была сразу заполнена всеми химическими элементами, поэтому в некоторых группах и периодах оставались пробелы. Так, ученые-химики предсказывали открытие новых веществ, что и произошло с неоном. Первым ученым, который задумался о существовании неона, стал химик Рамзай Рэлей. На то время были открыты два ближайших инертных газа: аргон и гелий, однако промежуточная ячейка в таблице была пуста. Ученый предположил, что новый элемент будет обладать атомной массой 20 и плотностью по водороду 10, однако, что такое неон в природе, не было известно.
Каким образом Рамзай смог выделить неон и доказать его существование? В его эксперименте использовался обычный атмосферный воздух, который сначала сжижали, а потом медленно испаряли. Полученные, таким образом, газообразные фракции изучали в разрядной трубке, что давало возможность увидеть линии спектра веществ. По этим линиям и нашли новый элемент.
Во вселенной шестым по счету наиболее распространенным элементом является неон. Значение слова с греческого переводится как «новый». Изначально сын Рамзая Вилли предложил назвать новый элемент новум, что также означало «новый», однако отец решил немного поменять это слово на неон, что, по его мнению, звучало лучше.
Свойства неона
Этот инертный газ находится в таблице Менделеева между аргоном и гелием, что придает ему промежуточные свойства этих веществ. Неон имеет два энергетических уровня, на которых располагаются 2 и 8 электронов. Эта особенность напрямую влияет на реакционную способность газа, т.к. он не образует соединений с другими элементами.
Что такое неон с точки зрения химии? Это легкий газ, который сжижается при температуре -245,98 °С, а планка кипения находится на отметке 2,6 °С. Растворимость газа в воде очень мала, однако адсорбция неона на активированном угле позволяет отделять чистый газ от его примесей.
Что такое неон с точки зрения физики? Это газ, который под воздействием тока разделяется на яркие красные и оранжевые спектры. Свет неона, который он излучает при этом, очень устойчивый и яркий. Физика этого явления заключается в ударении электронов об атомы неона, что заставляет последних выделять фотоны света.
Где находится неон
Во вселенной неон стоит на 6 месте по распространенности после гелия, водорода и ряда других элементов. Этот инертный газ занимает относительно большие объемы звезд и красных планет. При исследовании Плутона было выдвинуто предположение, что его атмосфера полностью состоит из неона, и в нижних слоях этот газ сжижается из-за критически низких температур на этой планете.
Что касается Земли, то неона больше всего содержится в атмосфере (0,00182%) и совсем немного в земной коре. Предполагают, что неспособность инертных газов связываться с другими элементами и образовывать минералы была основной причиной, по которой эти вещества на Земле остались в малом количестве.
Использование неона
Сейчас в производстве очень вырос спрос на неон, что означает его постоянную нехватку. Это связано с тем, что выделение чистого инертного газа занимает достаточно много времени, а его содержание в воздухе очень низкое.
Неон используется в промышленности как хладагент в криогенной технике. При температурах жидкого неона хранят ракетное топливо, замораживают животные и растительные ткани, химические вещества. В неоновых кристаллах создаются оптимальные условия для протекания очень сложных реакций, которые не терпят действие тепла (синтез Н2О2, фторидов кислорода и т.д.).
В некоторых лампах и светильниках также используется неон. Значение этого газа как источника света очень велико, т.к. его свечение видно на большие расстояния. Неоновые лампы используются для установки на маяк, аэродромные полосы, высотные башни. Некоторые текстовые рекламы подсвечиваются лампами на основе неона.
В таких светильниках неон не находится в чистом виде. Он всегда смешивается в нужных пропорциях с аргоном, что придает свету оранжевый цвет. Однако это никак не ухудшает свойства хорошей видимости, т.к. такие лампы заметны при любых неблагоприятных погодных условиях и на больших расстояниях.
Источник статьи: http://fb.ru/article/274511/chto-takoe-neon-himicheskie-i-fizicheskie-svoystva-neona-primenenie
Неон как пишется в химии
тв. – 1,444 г/см³ (при 24,66 К);
ж. – 1,204 г/см³ (при −246 °C);
газ. — 0,9002 кг/м³ (при −0 °C, 101,325 кПа) г/см³
Нео́н (лат. Neon ; обозначается символом Ne) — элемент восемнадцатой группы (по устаревшей классификации — главной подгруппы восьмой группы), второго периода периодической системы химических элементов, с атомным номером 10. Инертный газ. Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода.
Простое вещество неон — инертный одноатомный газ без цвета и запаха. Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
Содержание
История [ править ]
Неон открыли в июне 1898 года английские химики Уильям Рамзай и Морис Траверс [4] . Они выделили этот инертный газ «методом исключения» после того, как кислород, азот и все более тяжёлые компоненты воздуха были сжижены. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
Происхождение названия [ править ]
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше [5] .
Распространённость [ править ]
Во Вселенной [ править ]
В мировой материи неон распределен неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % [6] по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна [3] . В атмосфере многих звезд неон занимает третье место после водорода и гелия [7] .
Земная кора [ править ]
Из всех стабильных элементов второго периода неон — самый малораспространённый на Земле [8] . В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия [8] . Газовые туманности и некоторые звезды содержат неона во много раз больше, чем на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10 −3 % [3] [9] по объёму, а его общие запасы оцениваются в 7,8·10 14 м³ [3] . В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объёме воздуха содержится только 5,2 см³ гелия) [9] . Среднее содержание неона в земной коре мало − 7·10 −9 % по массе [3] . Всего на нашей планете около 6,6·10 10 т неона [источник не указан 4935 дней] . В изверженных породах находится около 10 9 т этого элемента [10] . По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете [источник не указан 4935 дней] .
Определение [ править ]
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа [3] .
Физические свойства [ править ]
- Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
- Насыщенность внешних электронных оболочек атомов инертных газов обусловливает более низкие точки сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства [ править ]
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne + , (NeAr) + , (NeH) + , и (HeNe) + .
Изотопы [ править ]
Существует три стабильных изотопа неона: 20 Ne (изотопная распространённость 90,48 %), 21 Ne (0,27 %) и 22 Ne (9,25 %) [11] . Повсеместно преобладает легкий 20 Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21 Ne и 22 Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций [12] , при которых образуются 21 Ne и 22 Ne — это захват альфа-частиц ядрами тяжелого кислорода 18 О и фтора 19 F:
Источник преобладающего на Земле лёгкого нуклида 20 Ne до сих пор не установлен.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20 Ne. В метеоритах обнаруживают немало 21 Ne и 22 Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует ещё шестнадцать нестабильных.
Получение [ править ]
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха на крупных промышленных установках. Разделение «неоно-гелиевой» смеси осуществляется несколькими способами за счет адсорбции и конденсации и низкотемпературной ректификации.
Адсорбционный метод основан на способности неона, в отличие от гелия, адсорбироваться активированным углем, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом, ректификационный способ основан на разнице температур кипения гелия и азота.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °C. В результате получают неон 99,9%-ной чистоты по объёму [3] .
Основным промышленным способом получения неона (в последнее десятилетие) является разделение неоно-гелиевой смеси путём низкотемпературной ректификации — смесь неона и гелия предварительно очищают от примеси азота и водорода (водород выжигают в печи, заполненной катализатором), а азот в низкотемпературных дефлегматорах и в блоке криогенных адсорберов, заполненных активированным углём (уголь охлаждается змеевиками с кипящим в них под вакуумом азотом). После удаления азота неоно-гелиевая смесь сжимается компрессором и поступает в ректификационную колонну (предварительно охлаждаемая до температуры кипящего под вакуумом азота) для разделения. Для понижения температуры охлаждённая смесь дросселируется с 25 МПа до 0,2-0,3 МПа (в зависимости от режима работы установки). В верхней части колонны, из-под крышки конденсатора, отбирается гелий с примесью до 20 % неона, в нижней части колонны в жидком виде получается неон. В качестве холодильного цикла используется дроссельный холодильный цикл с рабочей средой-хладагентом чистым неоном. Ректификационный метод разделения неоно-гелиевой смеси позволяет получить неон чистотой до 99,9999 %.
Промышленные установки по получению неона высокой чистоты построены и успешно эксплуатируются на Украине — г. Мариуполь (предприятие «Ингаз») и г. Одесса (предприятие «Айсблик»), в Российской Федерации — г. Москва.
Применение [ править ]
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Источник статьи: http://wp.wiki-wiki.ru/wp/index.php/%D0%9D%D0%B5%D0%BE%D0%BD
Неон как пишется в химии
НЕОН (от греч. neos-новый; лат. Neon) Ne, хим. элемент VIII гр. периодич. системы; относится к благородным газам; ат. н. 10, ат.м. 20,179. Природный неон состоит из изотопов 20 Ne (90,92% по объему), 21 Ne (0,257%), 22 Ne (8,82%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов не более 2,8 . 10 -28 м 2 . Известны коротко-живущие (T 1/2 2 2p 6 ; энергия ионизации Ne 0 

Содержание неона в атмосфере 1,82 . 10 -3 % по объему, в земной коре 7•10 -5 г/т; запасы неона оцениваются в 7,8 . 10 14 м 3 . Неон представлен в горячих звездах-красных гигантах, газовых туманностях, атмосфере Юпитера, Сатурна, Урана. Нептуна, Плутона. Считают, что в космосе преобладает 20 Ne.
Свойства. Неон-одноатомный газ без цвета и запаха, т. кип. 27,07 К (0,1 МПа); плотн. твердого 1,444 г/см 3 (24,66 К), жидкого 1,24 г/см 3 (25,0 К), газа 0,90035 кг/м 3 (273 К, 0,1 МПа); t крит 44,4 К, р крит 2,65 МПа, d крит 0,484 г/см 3 ; тройная точка: т-ра 24,66 К, давление 43,3 кПа, плотн. (жидкого) 1,247 г/см 3 ; С 0 p 20,79 ДжДмоль•К); DH 0 пл 0,335 кДж/моль, DH 0 исп 1,73 кДж/молъ; S 0 298 146,21 ДжДмоль . К); ур-ния температурной зависимости давления пара: над твер дым неоном lgp (Па) = – 108,931/T + 0,00640755T + 8,914700, над жидким lgp (Па) = – 84,37/T + 0,1118T + 7,82482 (24,66-27 К) и lgр(МПа) = -84,37/Т + 0,01118T + 3,81340 (27-44 К); теплопроводность 0,0443 Вт/(м . К) при 273 К и 0,1 МПа; л 2,93-10 -5 Па . с (273 К, 0,1 МПа); диамагнитен, магн. восприимчивость — 7,2 . 10 -6 ; поляризуемость 0,392 . 10 -30 м 3 ; коэф. самодиффузии 4,52 . 10 -5 м 2 /с (273 К, 0,1 МПа); коэф. сжимаемости при 273 К: 0,998 (0,1 МПа), 1,046 (10 МПа). Твердый неон кристаллизуется в кубич. гране-центрир. решетке, а = 0,667 нм (4,3 К), z = 4, пространств. группа Fm3m.
Р-римость неона в воде при 0,1 МПа (м 3 /кг): 0,014 . 10 -3 (273 К), 0,010 . 10 -3 (298 К). Неон химически инертен. Для него известны только соед. включения, напр. Ne . 6H 2 O, и экси-мерные молекулы, напр. Ne 2 *, NeF*, на переходах к-рых из метастабильного состояния в несвязанное генерируется лазерное излучение (105 нм для NeF*).
Получение. Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха (см. Воздуха разделение). Газообразные неон и гелий скапливаются в верх. части колонны высокого давления-в конденсаторе-испарителе, откуда под давлением ок. 0,55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N 2 . Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N 2 в адсорберы с активир. углем, из к-рых после нагревания поступает в газгольдер (содержание Ne + He до 70%); степень извлечения смеси газов 0,5-0,6. Послед. очистку от N 2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при т-ре жидкого N 2 , либо конденсац. методами-с помощью жидких Н 2 или неона (предварительно на СuО при 700 °С проводят очистку от примеси Н 2 ). В результате получают неон 99,9%-ной (по объему) чистоты.
Определение. Качественно неон определяют по спектрам испускания (характеристич. линии 585,25 нм и 540,05 нм), количественно-масс-спектрометрич. и хроматографич. методами анализа.
Применение. Неон и неоно-гелиевую смесь используют в качестве рабочей среды в газовых лазерах, для наполнения газоразрядных источников света, сигнальных ламп ЭВМ и радиотехн. аппаратуры, ламп-индикаторов и стабилизаторов напряжения, как хладагент в технике низких т-р.
Хранят и транспортируют неон в виде неоно-гелиевой смеси (40-60% Ne) под давлением 15 МПа в стальных баллонах емкостью 40 л, окрашенных в светло-коричневый цвет с надписью белыми буквами “неоно-гелиевая смесь”. Неон особой чистоты поставляется под давлением 15 МПа в стальных баллонах емкостью 5 и 10 л, окрашенных в черный цвет, с надписью белыми буквами “неон особой чистоты”.
Н еон открыли У. Рамзай и М. Траверс в 1898 спектральным способом при фракционировании воздуха.
Лит. см. при ст. Благородные газы. В. Б. Соколов.
Источник статьи: http://xumuk.ru/encyklopedia/2/2834.html